Nieve
viernes, 13 de enero de 2017
Práctica: Leyes de los Gaes
Aquí dejaremos un vídeo de un experimento muy sencillo que realizamos en casa, pero se puede observar la relación entre las tres variables más importantes de los gases; Temperatura, Volumen y Presión.
lunes, 9 de enero de 2017
Ley General de los Gases
Se define como gas ideal, aquel donde
todas las colisiones entre átomos o moléculas son perfectamente elásticas, y en
el que no hay fuerzas atractivas intermoleculares. Se puede visualizar como una
colección de esferas perfectamente rígidas que chocan unas con otras pero sin
interacción entre ellas.
Realmente; Los gases ideales no
existen, aunque, se pueden considerar a los gases con masa molecular no muy
alta, a presiones no muy bajas y, a temperaturas no excesivamente bajas, como
los tales gases ideales.
De forma que: Toda la energía interna está en forma de energía cinética y cualquier cambio en la energía
interna va acompañada de un cambio en la temperatura.
 |
| Aumento de la presión de un Gas aumentando la temperatura del recipiente que lo contiene por medio de agua. |
Como ya se mencionó antes, los gases cuentan con estas características básicas: Presión, Volumen, Temperatura.
PV = nRT = NkT
Donde:
n = número de moles
R = constante
universal de gas = 8.3145 J/mol K
N = número de
moléculas
k = constante de
Boltzmann = 1.38066 x 10-23 J/K = 8.617385 x 10-5eV/K
k = R/NA
NA =
número de Avogadro = 6.0221 x 1023 /mol
 |
| Temperatura, Presión y Volumen relacionados en la ley general de los gasas, la imagen muestra el comportamiento de un gas ideal en un recipiente. |
Principalmente la ley del gas ideal
puede ser vista como el resultado de la Presión cinética de las
moléculas del gas colisionando con las paredes del contenedor de acuerdo con
las leyes de Newton. Pero también existe un elemento estadístico en la
determinación de la energía cinética media de esas moléculas. La temperatura se
considera proporcional a la energía cinética media; lo cual invoca la idea
de cinética. Un mol de gas ideal a TPE (temperatura y
presión estándares), ocupa 22,4 litros.
 |
| Expansión de un gas en un recipiente con vacío. |
Las
células utilizan de manera continua oxígeno y producen dióxido de carbono.
Ambos gases entran y salen de los pulmones a través de las membranas de los
alvéolos, los pequeños sacos de aire que se encuentran en los extremos de las
vías respiratorias en los pulmones. Tiene lugar un intercambio de gases en el
cual el oxígeno del aire se difunde hacia los pulmones y la sangre, al tiempo
el dióxido de carbono producido en las células se transporta en los pulmones
para ser exhalado.
Dado que la presión parcial del oxígeno en la
sangre venosa es e 40 mmHg, el oxígeno se difunde de los alvéolos hacia el
torrente sanguíneo. El oxígeno se combina con la hemoglobina, que lo traspasa a
los tejidos del cuerpo, A medida que el oxígeno se agota en las células de
cuerpo durante los procesos metabólicos, se produce dióxido de carbono, ahí se
difunde fuera de la sangre hacia los alvéolos y se exhala. |
| Hematosis (intercambio de gases en nuestro cuerpo). |
Bibliografía:
1. A. Tliper, Paul; Física para la ciencia y tecnología. Ed. Reverté.
2. Héctor Pérez Montiel; Física Geneal; Ed. Patria.
sábado, 7 de enero de 2017
Leyes de los gases a partir de esta teoría
Se propone que a partir de las suposiciones básicas anteriormente mencionadas, deduciremos las leyes de los gases ideales y sus propiedades.
El estado de masa de un gas se
especifica indicando los valores correspondientes de su presión, volumen y
temperatura. Cuando el gas sufre diversos procesos, su estado descrito cambia
por otro.
Una clase de información importante
relativa a los gases es la ecuación que describe como cambian los valores de
Presión (P), Volumen (V) y Temperatura (T), de un estado a otro.
1. La presión
de un gas ideal es proporcional a la temperatura kelvin a volumen constante.
 |
| Proceso isocórico (volumen constante) |
2. El volumen de un gas a presión constante, de no más de unas cuantas atmósferas, es proporcional también a la temperatura kelvin. (Ejemplo: 273 cm₃ de aire seco a 0 °C se encierran en un tubo a presión atmosférica, por medio de un émbolo. Supongamos que la Presión atmosférica se conserva constante. Si la temperatura del aire confinado se eleva a 1°C, su volumen aumentará 1 cm₃ o sea, 1/273 de su volumen inicial a 0°C. Cuando la temperatura se sigue aumentando, la dilatación por un cambio de grado de temperatura es constante, de modo que a 100 °C el volumen del gas es de 373 cm₃).
viernes, 6 de enero de 2017
Movimiento Browniano
Robert Brown (1773 – 1858), biólogo inglés que descubrió por primera vez en 1828 un movimiento muy
particular que sufrían las partículas de polen y otros materiales microscópicos. Observó que el movimiento de éstos era errático, sin ningún
tipo de orden ni trayectoria.
 |
| Biólogo Robert Brown quien descubrió un movimiento extravagante de partículas de polen. |
En 1785, el mismo fenómeno había sido descrito por Jan Ingenhousz sobre partículas de carbón en alcohol. Pero tuvo que
esperarse hasta principios del siglo XX, para que pudiera darse una explicación precisa del fenómeno. Esta explicación se debe a
Albert Einstein:
El movimiento browniano es resultado de las
variaciones a nivel microscópico de los componentes de la materia o sea, los átomos. Se observa en algunas partículas microscópicas que
se hallan en un medio fluido (por ejemplo, polen en una gota de agua).
El movimiento aleatorio de estas partículas se debe a que su superficie es bombardeada incesantemente por
las moléculas (átomos) del fluido
sometido a una agitación térmica. Este bombardeo a escala atómica no es siempre completamente uniforme y sufre variaciones estadísticas
importantes. Así, la presión ejercida sobre los
lados puede variar ligeramente con el tiempo, y así se genera el movimiento observado.Tanto la difusión como la ósmosis se basan en el
movimiento browniano.
En síntesis,
el movimiento browniano refleja a escalas grandes las variaciones o
fluctuaciones de los átomos que conforman la materia. Por eso se le considera
la primera muestra de la realidad de los átomos como constituyentes de la
materia. |
| Se muestra el movimiento aleatorio de las moléculas sometido a una agitación térmica. |
1. Susana M. Rojas Pión, Sandra M. Sanabria Bohórquez, Fabián Torres Ardila, Judith Trujillo Téllez. 1998. El Movimiento Browniano. Rezza. Enciclopedia temática. Física (1, 204) Colombia: Norma, S.A,.
miércoles, 4 de enero de 2017
Presión y Temperatura bajo esta teoría
Como primera aplicación de esta teoría deduciremos una expresión que nos permita calcular la presión de un gas ideal es un recipiente en términos de cantidades microscópicas.
La presión de un gas es el resultado de colisiones entre sus moléculas y las paredes del recipiente. Durante su movimiento aleatorio, las moléculas del gas chocan con las paredes del recipiente y experimentan un cambio de cantidad de movimiento como resultado de la fuerza ejercida sobre ellas por las paredes.
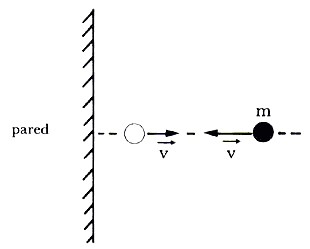 |
| Esta imagen ilustra el choque perpendicular de una molécula contra una pared. |
Si expresamos esta fuerza en términos de presión (fuerza/área), obtendremos lo siguiente:
Aquí V es el volumen del recipiente o gas, N es el número de moléculas de gas en el recipiente cerrado, m la mas de una molécula de gas y la rapidez "V eficaz" es la rapidez promedio de las moléculas. Se obtiene promediando los cuadrados de las velocidades y obteniendo después la raíz cuadrada del promedio, es decir:
Por ello, "V eficaz" también se denomina rapidez media cuadrática.
Esta es una relación de la presión de un gas con el promedio de energía cinética de las moléculas del gas.
Como toda la materia esta formada por átomos o moléculas en constante movimiento, a causa de su movimiento aleatorio las moléculas y los átomos tienen energía cinética (energía de movimiento).
La temperatura de un gas es una medida directa del promedio de energía cinética molecular del gas. Cuando la temperatura aumenta, las moléculas se mueven con una energía cinética mayor.
| Al aumentar la temperatura, el volumen aumentaría si la sustancia no se encontrara dentro de un recipiente; por lo tanto la presión aumenta, ya que se producen más choques entre las moléculas de la sustancia y el recipiente. |
~Relación con el área II~
Presión arterial: La presión arterial es uno de los signos vitales que un médico o una enfermera revisa durante una exploración física. Al actuar como bomba el corazón se contrae para crear la presión que empuja la sangre por el sistema circulatorio, durante la contracción, la presión arterial está en su punto más alto (la sistólica), cuando el musculo cardiaco se relaja, la presión arterial desciende; esta es la presión arterial sistólica.
Las presiones arteriales se miden con un esfigmomanómetro, un instrumento que consiste en un estetoscopio y un manguito inflable conectado a un tubo de mercurio denominado manómetro. El uso de monitores digitales de presión arterial es cada vez más común, sin embargo, no están validados para usarse en todas las situaciones y algunas veces las lecturas son inexactas.
 |
| Baumanómetro (instrumento empleado para medir la presión arterial). |
Bibliografía:
1. Jerry D. Wilson; Anthony J. Buffa; Bo Lou; Física (Quinta edición); Ed: Pearson Educación.
2. Héctor Pérez Montiel; Física Geneal; Ed. Patria.
Suscribirse a:
Comentarios (Atom)







