Como primera aplicación de esta teoría deduciremos una expresión que nos permita calcular la presión de un gas ideal es un recipiente en términos de cantidades microscópicas.
La presión de un gas es el resultado de colisiones entre sus moléculas y las paredes del recipiente. Durante su movimiento aleatorio, las moléculas del gas chocan con las paredes del recipiente y experimentan un cambio de cantidad de movimiento como resultado de la fuerza ejercida sobre ellas por las paredes.
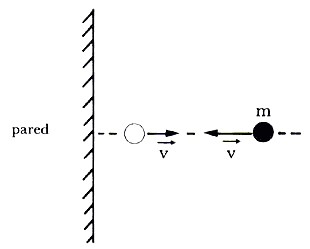 |
| Esta imagen ilustra el choque perpendicular de una molécula contra una pared. |
Si expresamos esta fuerza en términos de presión (fuerza/área), obtendremos lo siguiente:
Aquí V es el volumen del recipiente o gas, N es el número de moléculas de gas en el recipiente cerrado, m la mas de una molécula de gas y la rapidez "V eficaz" es la rapidez promedio de las moléculas. Se obtiene promediando los cuadrados de las velocidades y obteniendo después la raíz cuadrada del promedio, es decir:
Por ello, "V eficaz" también se denomina rapidez media cuadrática.
Esta es una relación de la presión de un gas con el promedio de energía cinética de las moléculas del gas.
Como toda la materia esta formada por átomos o moléculas en constante movimiento, a causa de su movimiento aleatorio las moléculas y los átomos tienen energía cinética (energía de movimiento).
La temperatura de un gas es una medida directa del promedio de energía cinética molecular del gas. Cuando la temperatura aumenta, las moléculas se mueven con una energía cinética mayor.
| Al aumentar la temperatura, el volumen aumentaría si la sustancia no se encontrara dentro de un recipiente; por lo tanto la presión aumenta, ya que se producen más choques entre las moléculas de la sustancia y el recipiente. |
~Relación con el área II~
Presión arterial: La presión arterial es uno de los signos vitales que un médico o una enfermera revisa durante una exploración física. Al actuar como bomba el corazón se contrae para crear la presión que empuja la sangre por el sistema circulatorio, durante la contracción, la presión arterial está en su punto más alto (la sistólica), cuando el musculo cardiaco se relaja, la presión arterial desciende; esta es la presión arterial sistólica.
Las presiones arteriales se miden con un esfigmomanómetro, un instrumento que consiste en un estetoscopio y un manguito inflable conectado a un tubo de mercurio denominado manómetro. El uso de monitores digitales de presión arterial es cada vez más común, sin embargo, no están validados para usarse en todas las situaciones y algunas veces las lecturas son inexactas.
 |
| Baumanómetro (instrumento empleado para medir la presión arterial). |
Bibliografía:
1. Jerry D. Wilson; Anthony J. Buffa; Bo Lou; Física (Quinta edición); Ed: Pearson Educación.
2. Héctor Pérez Montiel; Física Geneal; Ed. Patria.




No hay comentarios:
Publicar un comentario